STRUKTURELLE BIOCHEMIE DER MEIOSE
Wie werden homologe Chromosomen während der Meiose I miteinander verbunden? Wie wird die Maschinerie aufgebaut und reguliert?

Jeder von uns hat zwei Kopien von jedem Chromosom, eine von der Mutter und eine vom Vater. Diese Chromosomen sind einander sehr ähnlich und werden als Homologe bezeichnet. Wenn wir Gameten (d.h. Spermien oder Eizellen) produzieren, müssen wir die Anzahl der Chromosomen in diesen Zellen halbieren, damit unsere Kinder die richtige Anzahl von Chromosomen erben. Dies setzt voraus, dass die Homologe richtig voneinander getrennt werden. Wenn dieser Prozess schief läuft, kann dies zu Chromosomenstörungen wie Trisomie 21 führen.
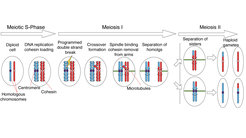
Um voneinander getrennt werden zu können, müssen die Homologe zunächst miteinander verbunden werden. Das ist eine Herausforderung, denn homologe Chromosomen sind normalerweise nicht miteinander verbunden. Es gibt einen Mechanismus namens homologe Rekombination (HR), der beschädigte DNA reparieren kann, indem er die korrekte Sequenz vom Homologen kopiert. Während der Meiose macht die Zelle programmierte Doppelstrangbrüche (DSBs) in ihrer eigenen DNA, die dann durch HR repariert werden, was wiederum zu Crossover-Bindungen zwischen den Homologen führt.
Der Ort, der Zeitpunkt und die Anzahl der DSBs werden streng kontrolliert. Außerdem werden nicht alle DSBs zu Crossovers verarbeitet. Die Homöostase von DNA-Brüchen und Crossovern ist lebenswichtig. Wenn zu viele DSBs auftreten, ist die Integrität des Genoms gefährdet, ebenso wenn DSBs in "verbotenen" Regionen des Genoms entstehen. Bei zu wenigen Brüchen ist es nicht möglich, die Kreuzungen zu erzeugen, die für eine sichere Verbindung von Homologen erforderlich sind.
Unser Ziel ist Folgendes:

Wichtige Veröffentlichungen
- Pesenti ME, Prumbaum D, Auckland P, Smith CM, Faesen AC, Petrovic A, Erent M, Maffini S, Pentakota S, Weir JR, Lin YC, Raunser S, McAinsh AD, Musacchio A. Reconstitution of a 26-Subunit Human Kinetochore Reveals Cooperative Microtubule Binding by CENP-OPQUR and NDC80. Mol Cell. 2018 Sep 20;71(6):923-939.e10.
- Pentakota S, Zhou K, Smith C, Maffini S, Petrovic A, Morgan GP, Weir JR, Vetter IR, Musacchio A, Luger K. Decoding the centromeric nucleosome through CENP-N. elife. 2017 Dec 27;6. pii: e33442.
- Weir JR*, Faesen AC*, Klare K*, Petrovic A, Basilico F, Fischböck J, Pentakota S, Keller J, Pesenti ME, Pan D, Vogt D, Wohlgemuth S, Herzog F, Musacchio A. Insights from biochemical reconstitution into the architecture of human kinetochores. Nature. 2016 Sep 8;537(7619):249-253.
- Klare K*, Weir JR*, Basilico F, Zimniak T, Massimiliano L, Ludwigs N, Herzog F, Musacchio A. CENP-C is a blueprint for constitutive centromere-associated network assembly within human kinetochores. J Cell Biol. 2015 Jul 6;210(1):11-22.
- Falk S*, Weir JR*, Hentschel J, Reichelt P, Bonneau F, Conti E. The molecular architecture of the TRAMP complex reveals the organization and interplay of its two catalytic activities. Mol Cell. 2014 Sep 18;55(6):856-867.
siehe vollständige Publikationsliste /tuefml/en/weir-group/weir-group-publications
Zukünftige Pläne
Wir wollen unsere biochemischen Rekonstruktionen so weit ausbauen, dass wir mit synthetischer DNA eine meiotische Kreuzung im Reagenzglas erzeugen können. Wir werden in zunehmendem Maße hybride strukturbiologische Ansätze verwenden und verschiedene Methoden kombinieren, um ein möglichst vollständiges Bild der Systeme zu erhalten, an denen wir interessiert sind. Außerdem wollen wir über die Verwendung von Hefe als Modellorganismus hinausgehen und beginnen, uns mit Phänomenen zu befassen, die spezifisch für die Meiose von Wirbeltieren und insbesondere des Menschen sind. Langfristig hoffen wir, dass unsere Arbeit auch für Kliniker von Nutzen sein könnte, die Menschen mit Fruchtbarkeitsproblemen oder genetischen Krankheiten helfen.







