Die Wiederherstellung des Zellkerns nach der Zellteilung
Forschungsbericht (importiert) 2011 - Friedrich-Miescher-Labor
Einführung
Im Jahre 1835 beobachtete der Tübinger Botaniker Hugo von Mohl zum ersten Mal die Teilung einer Pflanzenzelle unter dem Mikroskop. Seitdem untersuchten zahlreiche Forscher Zellen verschiedener Organismen mikroskopisch, um die Vorgänge, die bei der Teilung der Zelle und des Zellkerns (der Mitose) ablaufen, zu beschreiben. In den letzten Jahrzehnten wurden genetische und molekularbiologische Methoden entwickelt, die es ermöglichen, dass insbesondere viele Prozesse in der ersten Hälfte des Zellzyklus sogar auf der Stufe molekularer Details gut verstanden wurden. Weniger gut untersucht sind jedoch die Abläufe, die am Ende der Mitose bis zum Wiederaufbau eines funktionierenden Zellkerns führen. Dieser Frage gehen Wissenschaftler am Friedrich-Miescher-Labor in Tübingen nach.
Der Zellkern in der Interphase
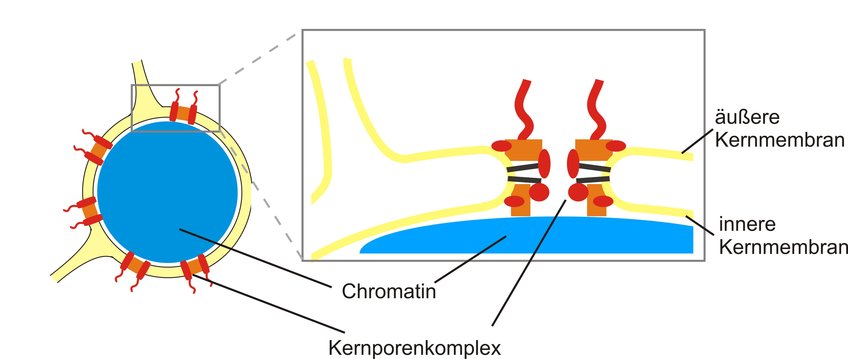
Der Zellkern ist das im Lichtmikroskop am leichtesten zu erkennende Organell der eukaryontischen Zelle. In Säugetierzellen hat der Zellkern einen Durchmesser von etwa 5 bis 15 µm. Er enthält den größten Anteil des genetischen Materials, der DNA. Der Zellkern wird durch die Kernhülle begrenzt (Abb. 1), die aus zwei biologischen Membranen, der inneren und äußeren Kernmembran, besteht [1]. Biologische Membranen sind aus einer Doppelschicht von Lipiden aufgebaut und aufgrund ihrer wasserabweisenden Natur undurchlässig für viele Substanzen. Die Kernhülle stellt somit eine physikalische Barriere zwischen dem Inneren des Zellkerns und dem Zellplasma dar; sie verhindert einen unkontrollierten Stoffaustauch zwischen diesen beiden Zellbereichen. Dennoch muss zwischen ihnen ein effizienter und geregelter Transport von Molekülen stattfinden, damit die Zelle die im Zellkern gespeicherte genetische Information umsetzen kann. Dieser Transport erfolgt durch Kernporenkomplexe, die in die beiden Membranen der Kernhülle eingebettet sind. Sie vermitteln den Austausch von Molekülen zwischen dem Zellkern und dem Zellplasma [2].

Um Proteine in der Zelle herzustellen, muss die in der DNA gespeicherte Information im Zellkern in eine so genannte Boten-RNA (mRNA) umgeschrieben werden. Diesen Prozess bezeichnet man als Transkription. Die mRNA wird im Zellplasma als Bauanleitung für die Proteinherstellung benötigt und muss deswegen aus dem Zellkern durch die Kernporenkomplexe hindurch transportiert werden. Da die Proteinherstellung nur im Zellplasma stattfinden kann, müssen Proteine, die wiederum im Zellkern benötigt werden, aus dem Zellplasma in den Kern gelangen - hierbei müssen wieder die Kernporenkomplexe passiert werden. Deswegen findet durch die Kernporen ein ständiger, effizienter Transportfluss statt, der auf einige hundert Moleküle pro Kernpore und Sekunde geschätzt wird.
Die meiste Zeit befinden sich Zellen in der so genannten Interphase. Ihre Zellkerne sind dann von einer kompletten Kernhülle umgeben und es findet ein aktiver Stoffaustausch zwischen dem Zellplasma und dem Innern des Zellkerns statt. Der Aufbau der Zelle und vor allem das Erscheinungsbild des Zellkerns verändern sich jedoch dramatisch, sobald sich Zellen und der Zellkern zu teilen beginnen. Diesen Vorgang bezeichnet man als Mitose, bei der sichergestellt werden muss, dass die beiden entstehenden Tochterzellen die gesamte und gleiche Erbinformation erhalten. Um dies zu gewährleisten, muss die DNA zuerst im Zellkern kopiert werden - dieser Vorgang wird als Replikation bezeichnet. Danach wird die DNA auf die beiden entstehenden Tochterzellen verteilt. Dies ist ein beachtliches logistisches Unterfangen, das in perfekt kontrollierten Prozessen während einer Mitose abläuft (Abb. 2).

In einem ersten Schritt verdichten sich die einzelnen DNA-Stränge zu Chromosomen, der Transportform der DNA, und bei Mehrzellern fällt die Kernhülle zu Beginn der Mitose auseinander. Das bedeutet, dass die Membranen der Kernhülle in kleinere Membranstückchen zerlegt werden. Die Kernporenkomplexe wiederum zerfallen in ihre einzelnen Proteinbausteine, die Nukleoporine - diese verteilen sich im gesamten Zellplasma. Die Chromosomen schließlich werden in der Zellmitte gesammelt und anschließend auf die beiden Tochterzellen gleichmäßig verteilt. Dies geschieht durch den mitotischen Spindelapparat, der aus langen Proteinpolymeren, den so genannten Mikrotubuli, aufgebaut ist.
Am Ende der Mitose muss sich in den Tochterzellen dann wieder eine Kernhülle um die DNA herum ausbilden. Hierzu dekondensiert zunächst die DNA, und Membranstückchen binden an die DNA-Oberfläche und verschmelzen schließlich miteinander. Gleichzeitig müssen sich erneut Kernporenkomplexe aufbauen, um den Transport durch die neu entstandene Kernhülle zu gewährleisten. Diese eindrucksvollen, lichtmikroskopisch sichtbaren Vorgänge der Mitose, die Kondensierung und Dekondensierung der DNA sowie der Ab- und Aufbau der Kernhülle faszinieren seit langem die Zellbiologen [3]. Aber trotz des enormen Erkenntniszuwachses in den letzten Jahren sind viele Aspekte der Zellteilung, vor allem die Prozesse der späten Mitose, auf molekularer Ebene gar nicht oder nur unzureichend verstanden.
Aufbau des Zellkerns im Reagenzglas

Bei der Frage nach dem Wiederaufbau des Zellkerns am Ende der Mitose geht es in erster Linie darum, wie das kompakte mitotische Chromatin dekondensiert, wie die Doppelmembran aus innerer und äußerer Kernhülle entsteht und das dekondensierte Chromatin umschließt und wie die Kernporenkomplexe aufgebaut werden. Zellbiologen sind immer wieder begeistert zu beobachten, wie sich die gigantischen molekularen Strukturen der Kernporen – sie betragen das 15-fache der Masse eines Ribosoms (den „Fabriken“ der Proteinherstellung im Zytoplasma) - aus ihren Einzelbestandteilen, den Nukleoporinen, aufbauen und in die Doppelmembran integrieren.

In Extrakten aus Eiern des südafrikanischen Krallenfrosches Xenopus laevis (Abb. 3) lassen sich viele Vorgänge wie DNA-Replikation, Import von Proteinen in den Zellkern, Aufbau der mitotischen Spindel und eben auch der Aufbau des Zellkerns am Ende der Mitose nachstellen und untersuchen [4]. So können in Eiextrakten durch Inkubation von mitotischem Chromatin die Chromatindekondensierung induziert und Zellkerne im Reagenzglas hergestellt werden. Während solch einer Reaktion löst sich zuerst die Chromsomenstruktur auf, sodass die Chromosomen scheinbar miteinander verschmelzen und eine mehr oder weniger homogene Struktur bilden (Abb. 4). Zeitgleich binden Membranvesikel und einige der Nukleoporine an die DNA-Oberfläche. Diese zuerst bindenden Nukleoporine agieren als Kristallisationspunkte für den weiteren Aufbau der Kernporen. Die Membranvesikel verschmelzen anschließend miteinander, sodass eine geschlossene innere und äußere Kernmembran entsteht. Gleichzeitig binden weitere Nukleoporine an die DNA und bilden intakte Kernporenkomplexe aus. Es wird vermutet, dass die Dekondensierung des Chromatins sowie der Aufbau der Kernmembranen und der Kernporen nicht nur zeitlich koordiniert, sondern auch mechanisch verknüpft sind: Um zu verhindern, dass sich beipielsweise eine Kernhülle ohne Kernporen um die DNA ausbildet und somit die Zelle den Zugang zu ihrer Erbinformation verliert, können die Kernmembranen nur an dekondensiertes Chromatin binden und sich nur dann ausbilden, wenn auch gleichzeitig Kernporen entstehen [5].
Da die Reaktion im Reagenzglas abläuft, lässt sie sich recht einfach manipulieren. So kann man sie beispielsweise an bestimmten Punkten anhalten oder einzelne Proteine aus dem Zellextrakt entfernen und den Effekt solch eines Verlustes studieren. Solche Experimente ermöglichten es bereits, für einige Faktoren und Proteine festzustellen, in welchen der Schritte sie eingebunden sind.
Chromatin, Membranen und Proteine
Die Wissenschaftler wollen nun verstehen, welche Faktoren speziell für die Chromatindekondensierung notwendig sind. Dazu kann man bestimmte Proteine, von denen man vermutet, dass sie eine Rolle spielen, aus den Eiextrakten gezielt entfernen. Funktionieren solche „depletierten“ Extrakte im Verlauf der Chromatindekondensierung nicht mehr, ist das ein deutlicher Hinweis darauf, dass das fehlende Protein tatsächlich notwendig ist. Umgekehrt kann man die Eiextrakte biochemisch in ihre verschiedenen Proteinkomponenten auftrennen und untersuchen, welche der Komponenten für die Chromatindekondensierung notwendig sind, indem man Komponente für Komponente wieder dazugibt und prüft, ob die Chromatindekondensierung wieder einsetzt.
Um zu verstehen, wie Kernporenkomplexe aus den einzelnen Nukleoporinen zusammengesetzt sind, werden nicht bereits fertige Kernporenkomplexe untersucht, sondern die Wissenschaftler schauen sich den schrittweisen Zusammenbau der Kernporenkomplexe an – und zwar am Ende der Mitose. Dabei soll zuerst geklärt werden, wie die einzelnen Nukleoporine aneinander binden und zu größeren Einheiten werden, die dann wiederum als Module für den Kernporenaufbau fungieren. Da die einzelnen Module zu unterschiedlichen Zeitpunkten an die DNA-Oberfläche beziehungsweise aneinander binden, soll untersucht werden, welche Module wann und woran binden, um so darstellen zu können, wie der Bauplan eines Kernporenkomplexes aussieht. Durch solche Experimente ist es in den letzten Jahren beispielsweise gelungen, Nukleoporine zu identifizieren, die früh an das Chromatin binden und als Kristallisationspunkte für den weiteren Kernporenaufbau fungieren [6]. Auch wurde herausgefunden, welche Nukleoporine mindestens notwendig sind, um Kernporen aufzubauen [7].
Ausblick
Der Wiederaufbau des Zellkerns am Ende der Mitose ist ein faszinierendes Beispiel für die Selbstorganisation komplexer zellulärer Prozesse und Strukturen. DNA, Proteine und Lipidmembranen müssen hierbei exakt zusammenspielen. Einige strukturelle Bausteine sind bereits bekannt, andere warten noch auf ihre Entdeckung und Charakterisierung. Weitgehend unbekannt ist bislang, wie diese Prozesse gesteuert und reguliert werden, denn es reicht eben nicht nur, die einzelnen Bausteine für den Bau einer Maschine zu kennen - man muss auch wissen, wie und wann man sie einsetzt. Wie das die Zelle bewerkstelligt, ist immer noch weitestgehend unklar – und für Zellbiologen beeindruckend.